参比电极基础知识(类型,电势和液接电势)
- 引言
- 氯化银电极
- 甘汞电极
- 不含氯型电极
- 非水型电极
- 可逆氢电极
- 液接电势
- 溶液电阻和阻抗
1. 简介
Professor Noriyuki Watanabe
在电化学中,为了使特定的反应发生,需要在工作电极上外加一个稳定的电势。工作电极的电位应始终精确地控制。这就是为什么需要一个参比电极作为电势参考标准的原因。
- 金属电极(铂,金,汞,银等)
- 内部电解质溶液
- 液接部(陶瓷,离子透过型多孔玻璃等材料)
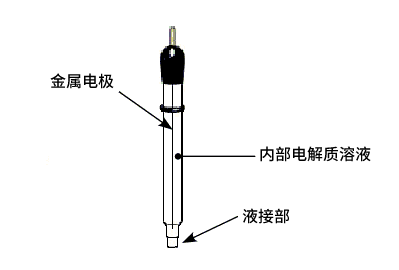
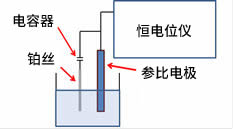
通常一个玻璃小管(有时为了防腐蚀也会使用特氟龙小管)被用作上面这三个基本组成的组合用容器。玻璃管前端的液接部用于和被测试样溶液进行接触电传导。对于一个参比电极一般要求其电势能够长期保持恒定。因此,不能让电流流经参比电极。一般情况下参比电极必须连接到一个带高阻抗的电路中,那是因为流经的电流可能会导致参比电极发生电势漂移。所以恒电位仪的参比电极的连接端是一个带高阻抗输入的端子。从而严格限制了参比电极的电流通过。
仅仅将一根铂丝浸在试样溶液中,并将其与恒电位仪的参比电极端链接,此时电位仪与试样溶液之间有电接触传导,所以可将其称之为伪参比电极,但这种构成是不能保证测量时电极电势的稳定性或重复性。值得注意的是,只有连接一个可靠的参比电极重复性好的测量才有可能实现。值得注意的是,只有使用一个可靠的参比电极才有可能实现重复性良好的测量。
虽然电流不流过参比电极,但是参比电极本身的内部阻抗还应尽可能地小。由于恒电位仪是一个自动控制系统,在反馈回路中包含一个高阻抗元件会导致响应速率的降低(换句话说,带宽变窄),其将会不稳定以至于发生电路振荡。
要防止参比电极末端的液接部出现析出物附着,因为析出物可能会导致参比电极非常高的阻抗。
标准氢电极(SHE)是电势的第一参考标准,但因氢气的处理操作非常麻烦和不便,其不太适合在日常测量中的使用。作为标准氢电极的替代品,第二参考标准的参比电极例如饱和甘汞电极(SCE),银-氯化银电极(SSCE)和可逆氢电极(RHE)等是公认的常用型参比电极。
为什么参比电极能保持一个恒定的电势?
原因是在电极表面有可逆的氧化还原反应发生,并且能一直保持平衡态,例如下面所示的几个反应。
SCE Hg + Cl- ⇔ 1/2Hg2Cl2 + e- (+0.24V)
SSCE Ag + Cl- ⇔ AgCl + e- (+0.20V)
像这样可以形成平衡的氧化还原电对的电极被称为参比电极。参比电极的电势不会从外部被改变,因此它被称为非极化电极。
众所周知各种参比电极之间的相对电势是固定的,其重要性主要体现在,只要使用的特定的参比电极,即使是不同的时间地点得到的实验数据之间也可以进行对照比较。
2. 银-氯化银电极 (SSCE)
Professor Noriyuki Watanabe
参比电极应在平衡状态下使用,因此连接参比电极的电路中的净电流希望能为零。或者更确切地说,它必须在零电流下使用。恒电位仪连接参比电极的端子具有极高的输入阻抗,为的是不让电流流经参比电极。这是恒电位仪的重要功能之一。
目前最常用的参比电极是银-氯化银(Ag/AgCl)电极。与使用汞及其盐的甘汞电极相比Ag/AgCl电极是环保的。其电极电势也具有充分的稳定性,可靠性和再现性。
Ag + Cl- ⇔ AgCl + e- (+0.20V)
上式中的正向反应(⇒)为氧化反应,逆向反应为还原反应。两个反应均处于平衡状态。
氯离子(Cl-)来源于内部的电解质(氯化钾或氯化钠)。银为银线本身。AgCl是银丝表面上形成的固体薄层。
Ag/AgCl电极是比较容易制备的。只需把清洗过的银丝在含有氯离子的水溶液(氯化钾或氯化氢等)中进行阳极电镀。在银丝表面形成的膜起初是淡淡的粉红色,然后渐渐变成暗灰色。然后把电镀后的银丝放入装有KCl溶液的玻璃管,玻璃管末端的液接部可以与测试溶液进行电接触(如图2-1所示)。
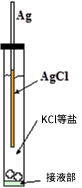
图2-1 Ag/AgCl 电极的构成示意图
上述反应的电极电势如下。
用AgCl的溶度积常数KsAgCl替代银离子活度,方程式(1)就变换为方程式(2)。
利用E0Ag+ 和KsAgCl的文献值(E0Ag+=0.7991 V, KsAgCl = [Ag+][Cl-] = 1.6×10-10),就可以得到我们熟悉的方程式(3)。
aCl-是电极内部溶液中氯离子的活度。因此,Ag/AgCl参比电极的电势除温度影响之外,还取决于氯离子的活度影响。氯离子的活度增加导致电势向负方向移动。因此,为了获得可重复性结果保持内部的氯离子浓度不变很重要。
饱和SSCE的参比电势(在饱和氯化钾中)在25度下相对标准氢电极(SHE)为0.197 V。参比电极与被测试样溶液的电接触是通过接液部使得内部溶液和测试溶液之间进行离子的相互传递。
除KCl外,NaCl有时也被用作内部电解质。当测试溶液中含有高氯酸根负离子时、NaCl往往被作为内部电解质,理由是高氯酸钾的溶解度低于钠盐。接液部内部的高氯酸钾的析出可能导致像参比电极阻抗大幅度增加这样的严重问题。
使用氯化钾的主要原因是,钾离子和氯离子具有相同的离子淌度,因此含这些离子的液体界面的液接电势是最小的。那么,以NaCl为内部电解液时液接电势变得有些大。使用哪一个更好就需要根据实际情况权衡利弊。
参比电极的保管很重要,否则会导致参比电极的电势漂移。参比电极应该放在与内部溶液相同成分且未经使用的溶液中。要避免来源于外部物质的接液部的污染或析出物,否则会造成如外部噪声等引起恒电位仪的不稳定。
检查Ag/AgCl参比电极的方法
如果需要检查参比电极的电势是否准确,可以通过测量与同类型新的电极之间的电势差来进行比较。
因为反应池中的两个参比电极是相同的,理想的电势差应是0V, 但是实际上会有小的电势差。如果电势差在0 ± 20 mV范围内,仍然可以使用。
将参比电极浸在3 M的NaCl溶液或饱和KCl溶液中,然后使用电压表测量他们间的电势差。
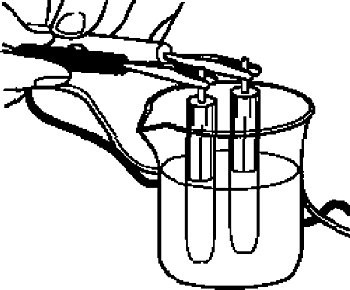
图2-2 检查Ag/AgCl参比电极的电势差方法示意图
各种参比电极的参考电极电势(25oC):
NHE(一般氢电极) ……………………0mV
SCE(饱和甘汞电极) ………………241mV
SSCE(钠饱和甘汞电极) ………… 236mV
Ag/AgCl(饱和 NaCl) …………… 201mV
Ag/AgCl(饱和 KCl) ………………198mV
Hg/HgSO4(饱和 HgSO4) ……… 616mV
Cu/CuSO4(饱和 CuSO4) ……… 300mV
3. 甘汞电极
Professor Noriyuki Watanabe
电极电势可用方程式表示如下
在方程式(2)右边的前两项被E0Hg2Cl2/Hg所置换,从氧化还原电势的文献值(E0Hg22+/Hg = 0.7960V) 和
溶度积常数(KsHg2Cl2=2×10-18)计算出其值为0.273V。
把E0Hg2Cl2/Hg置换为E0,就得到了方程式(3)我们所熟悉的关于氯离子活度的公式。
在电化学研究初期SCE曾经替代SHE参比电极使用。然而,由于环境问题它的使用已接近停滞。但是,SCE依然处于重要且不可或缺的地位。事实上,我们可以看到许多最近的研究论文中依然使用SCE。图3-1为SCE电极的典型结构示意图。
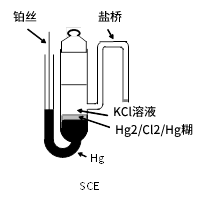
图3-1 SCE电极的典型结构示意图
SCE的参比电势为0.241V(25 °C),因为在饱和氯化钾(约4.8 M)内部溶液中,氯离子的活度增加。电极电势除了受氯离子浓度的影响,也受到温度影响,温度每增加1度,电势就变化约-0.5 mV。1 M KCl和0.1 M KCl的参比电势分别为0.280 V和0.334 V。温度依存的电势变化随着KCl的浓度越高变化也越大。
图3-1中,从SCE电极主体侧面延伸出来的作为盐桥的细管,由于其脆弱易损,日常使用时不方便。因此,一般把汞放置在最上面,然后在它下面填充汞-氯化亚汞糊,下面用陶瓷等支撑。比如我们生产的RE-2BP电极(图3-2)就是这种类型的SCE电极。

图3-2 甘汞参比电极 RE-2BP
我们经常被问到这样的问题“SCE甘汞参比电极 可以在有机溶剂中使用吗?”。答案是“可以”。然而,在需要避免水或氯离子污染的情况下,建议使用一个盐桥,并使用与被测试样溶液相同的电解质溶液(有机溶剂和电解质)。即便如此,必须注意, SCE和盐桥之间会存在一个相当大的未知液接电势。此外,还应考虑到液接部存在被析出物堵塞的危险,在有机溶剂中最好使用非水溶剂用参比电极(如Ag/Ag+有机溶剂)或准参比电极(如铂丝),然后再用内标物比如二茂铁作为电势参照标准。
4. 不含氯离子的参比电极
Professor Noriyuki Watanabe
4.1 汞-氧化汞(Hg- HgO)参比电极
汞-氧化汞(Hg- HgO)参比电极主要用于强碱性溶液。当碱性溶液作为内部溶液时,利用汞及氢氧根阴离子之间形成的汞氧化层的平衡反应。其连续反应如下。
HgO + H2O ⇔ Hg(OH)2 ⇔ Hg2+ + 2OH- (2)
反应式(1 )的电极电势可以用式(3 )表示。
可以用溶度积常数导出汞离子的活度 aHg2+ = Ks(Hg(OH)2) /(aOH-)2,式(3 )可以变换为式(4 )。
如银-氯化银的章节中所描述的,使用高度不溶性盐的参比电极的标准电势明显取决于其溶度积常数。
用 E0Hg/Hg2+ = 0.8537 和 Ks(Hg(OH)2) ≃ 10-25, 代入方程式(4)最终得到下式(5)。
内部电解质通常使用0.1 M, 1 M, 3 M 和饱和NaOH 或KOH时,有时也使用饱和Ca(OH)2 或 Ba(OH)2,因为他们有低于NaOH 或KOH的溶解度。这些碱金属溶液中OH -活度较低,有利于玻璃管的使用,并向上提高了标准电势。1 M KOH, 1 M NaOH, 饱和 Ba(OH) 2 和饱和 Ca(OH) 2的标准电势分别为,110 mV, 113 mV, 146 mV 和 192 mV。
4.2 汞-硫酸亚汞(Hg-Hg2SO4)参比电极
电极反应和电极电势如下所示。
方程式(7)利用汞离子的活度和溶度积常数Ks(Hg2SO4), (Ks(Hg2SO4) = [Hg22+][SO42-])之间的关系,变换为下式。
把E0Hg/Hg22+ = 0.7960V(25°C)和Ks(Hg2SO4) ≃ 7×10-7,代入方程式(8),最后形成如下所示方程。
硫酸亚汞较大的溶解度使得这类电极相对于甘汞电极有着更为正向的参比电势。饱和K2SO4 或 1 M H2SO4为内部电解液。
在需要避免氯离子污染的情况下,该参比电极是一个合适的选择。
日本BAS公司的RE-61AP 为Hg-HgO电极,RE-2CP 为 Hg- Hg2SO4电极。
 RE-61AP |
 RE-2CP |
5. 非水电极
Professor Noriyuki Watanabe
在这一节中,我们介绍一个适用于有机溶剂的参比标准。通过在试样溶液和参比电极之间放置一个适当的盐桥,水溶液用参比电极也可以在有机溶剂中使用。事实上,在很多文献中可以看到相对SCE或Ag-AgCl的氧化还原电势的描述。这些文献中有许多忽略了水系参比电极和有机试验溶液之间的液接电势。因此,很难把我们的研究结果与文献值比较或评价文献值之间的差异。考虑到由于水或氯离子会造成不可避免的污染,并且会导致难以确定的液接电势,最好不要把水系参比电极用于非水系的研究。
一般非水溶剂中使用Ag +-Ag型电极。电极的基本构造和Ag-AgCl电极相似。银线被置入一个装有少量银盐,有机溶剂及大量的电解质的玻璃管中。在大多数情况下,采用乙腈作为内部溶剂。用于分析溶液的溶剂在许多情况下也可使用。电解质是由烷基铵R4N +(R =甲基,乙基,丙基和丁基等)作为阳离子和高氯酸盐ClO 4-,六氟磷酸盐PF 6-和四氟硼酸盐BF 4-等阴离子组成。
只要不超过溶解度极限(通常大于0.1 M)电解质的浓度越大越好。此外,溶解少量银盐(0.01 M, NO 3-, ClO 4-, PF 6- 与BF 4-等盐)作为Ag +源。这种电极的长期的稳定性和良好的再现性并不太好。还有,参比电势取决于溶剂的种类。因此,仅靠Ag-Ag +电极来决定测试化合物的氧化还原电势是不足够的。IUPAC(国际纯粹与应用化学联合会)推荐使用,如二茂铁或双酚铬(I)作为内部标准。这些化合物的氧化还原电势不那么依赖于使用溶剂的种类。推断其原因是,由于作为氧化还原位的,二茂铁中的Fe2+/3+,和二苯铬中的Cr +1/0分别夹在戊二烯环和苯环中,被有效地从周围的介质中遮蔽出来。
甚至在使用Ag-Ag+参比电极时,也应该把二茂铁或二苯铬的氧化还原电势作为常规电势标准。二茂铁的氧化还原电势相对SHE约为+ 0.7 V,二苯铬的氧化还原电势(I)相对二茂铁是-1.15 V(对SHE约-0.45 V)。无论是事先添加到测试溶液中,还是测试后添加再测量都可以。使用内部标准的优点是,通过二茂铁的氧化还原电势作为媒介,使与SHE电势值进行比较变得可能。
虽然Ag-Ag+ (Ag+ + e-⇔ Ag) 在水溶液中的氧化还原电势为0.7991 V vs SHE,主要由于阳离子的溶剂化能的区别,这个值在有机溶剂中有很大变化。例如,在二氯甲烷中为0.65 V,在四氢呋喃中为0.41 V,乙腈中为0.04 V。由于氧化剂(阳离子)在极性溶剂中是稳定的,依据溶剂种类不稳定的程度不同氧化还原电势移向负方向。因此, Ag-Ag+非水参比电极可能不适合测化合物的氧化还原电势,只是作为参比电极。在论文中作为氧化还原电势的内部标准还是可行的。二甲基甲酰胺(DMF)和二氯甲烷由于与银离子的反应以及溶解性的理由,被认为是不适合的溶剂。
在非水系中使用伪参比电极也是一种方法。只要把铂丝浸入到试验溶液中并连接到恒电位仪的参比端子(因为恒电位仪有一个参比电极端子必须被连接),它不能保持开放。虽然具体电势不能确定,但考虑到铂丝较低的阻抗并可排除液接电势,也可成为一种选择。当然,用于出版物时就需要内部标准。
如何使用非水参比电极
当非水参比电极直接浸入试样溶液,在IPPG(离子渗透性多孔玻璃)孔中的参比电极内部溶液中的支持电解质,会溶解在试样中或与试样反应,这可能是孔堵塞的原因。使用试样架桥管,如下面的例子所示,就可以防止这样的事情发生。
将电解质溶液装入试样架桥管,并检查IPPG接液处有无气泡。如果有一些气泡,轻弹把气泡除去。气泡的存在使得离子渗透性会有所不同,它会改变印加电势。
然后,将非水参比电极放到试样架桥管中。移动O型圈设置参比电极的位置。把电解质溶液添加到试样架桥管中,作为参比电极,所印加的电势将保持恒定。
如果你想以这样的方式使用参比电极,请使用SVC-2伏安电化学池。在使用一个新的试样架桥管时请先将它在溶液中浸泡一晚。让溶液渗透到IPPG的孔中,以增加离子的渗透性,使其可以用来进行循环伏安实验。
6. 可逆氢电极 (RHE)
Professor Noriyuki Watanabe
电极电势的基本标准是标准氢电极(SHE),它是把具有大的表面积的铂电极浸在含有标准活度的质子和氢气(H+和H2活度= 1)的酸性溶液中而形成的(如图1所示)。使用铂电极是利用其氢的氧化还原反应的高活度。Pt电极表面镀铂是为了通过增加表面积来进一步提高活度。为了使氢气含量保持在稳定状态,必须向内部溶液持续通氢气。
电极反应和电极电势如下所示。
2H+ + 2e ⇄ H2 (1)
E = E0 + (RT/F) ln aH+ - (RT/2F) ln pH2 (2)
理所当然E = 0这在电化学界是共识。在标准的状态下,方程式(2)右方的两项都是零。因此,认为标准状态的氢电极E = 0。
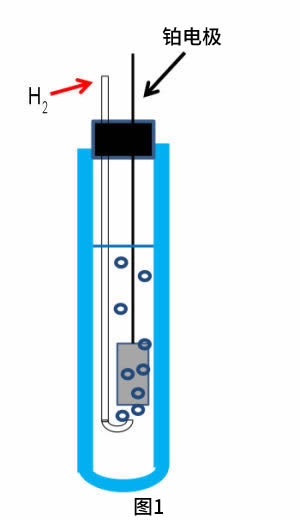
根据方程式(2),电极电势依赖于氢离子浓度(活度,a H+),和氢气分压(p H2)。
然而,SHE在实际使用中并不方便。因此通常的做法是使用日常使用的电极。然后如许多情况下,使用众所周知的电势差把实验值转换到SHE参比电势来报告。例如,使用SCE时, SHE = SCE + 0.241。
有一个在短时间内获得近似SHE的简单方法,称为可逆氢电极(RHE),或称为相对氢电极。日本BAS公司提供的品名为RHEK的产品就是可以用来临时使用的氢电极。它基本上由参比电极本身生产氢气,在每一次实验时由用户操作。
RHEK的操作步骤如下。在强酸性溶液的情况下,经过虹吸把强酸性溶液吸入RHE本体(图2),通过阴极电解产生氢气并存储氢气于电极本体(图3)。然后,你可以执行你的主要目的,把曾经用于电解产生氢气的工作电极端子连接到测试溶液的工作电极,然后把曾经连接到对电极的参比端子连接到参比电极(图4)。
 |
 |
 |
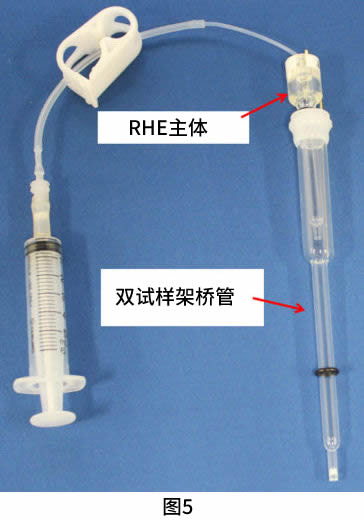
在中等酸性和中性溶液或甚至强酸性溶液的情况下,建议使用双液试样架桥管(图5)。在试样架桥管中氢气的生成与上述所提到的过程相似。在试样架桥管尖端有接液部、架桥管可以从生产氢气的强酸溶液直接转移到测试溶液中。这样,RHE结合架桥管成为参比电极(图6)。

7. 液接电势
Professor Noriyuki Watanabe
使用一个参比电极必然会在参比电极和测试溶液之间的存在液-液界面。当参比电极使用盐桥的时,增加了额外的界面。在这样的界面上不可避免地产生液接电势,液接电势的大小取决于电解质溶液的组成。不同组分的离子通过界面时,各自的离子迁移率的不同是产生液接电势的根源。根据亨德森方程,使用离子迁移率和组成电解质的浓度,计算出液接电势的大小。虽然方程看起来复杂,包括离子迁移率,离子电荷和组成离子的浓度,它是被简化的,因为只有几个主要组成部分是有效的。
当你在参比电极和测试溶液间使用盐桥时,为了尽量减低液接电势而明智的选择电解质成分很重要。往往选择K+、NH4+、Cl-、 NO3-的组合,是因为他们具有类似的迁移率。
由于KCl的溶解度非常低(水中的饱和浓度大约为4.8 M),考虑到成本费用有时会使用CsCl或RbCl。Rb+ 和 Cs+的迁移率几乎和Cl-相同。当KCl = 1.000时的其他离子的相对迁移率如表所示。
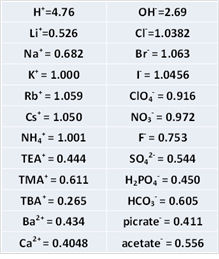
当试验溶液中有高氯酸阴离子时用NaCl来替代KCl。其原因是高氯酸钾的溶解度相当低,而高氯酸钠的溶解度约为一百倍。由于KClO4的溶解度低,通过这个对策来降低接液部析出的风险。使用哪一个需要权衡利弊。
日本BAS公司提供具有离子透过型多孔玻璃的试样架桥架管。它也可用作盐桥或参比电极的制备。
8. 溶液电阻和阻抗
Professor Noriyuki Watanabe
恒电位仪只能控制工作电极和参比电极之间的印加电势,当两个电极间有电流i流过电解槽,两个电极之间存在未知的溶液阻抗Ru,从而产生不被希望出现的电压损失(i x Ru)。这种阻抗称为未补偿电阻,它使循环伏安法中的氧化和还原峰电位出现额外的分离。由于峰值分离,也可能是相对快速的电位扫描下的不可逆的电子转移扩大造成的。如此峰值分离的缘由会被误导。恒电位仪具有补偿i x Ru的功能,通过电的正反馈虽然不能完全消除,但是尽可能减少这种额外的损失。在不干扰分析物向工作电极扩散的范围内,使参比电极的位置尽可能靠近工作电极。还有一种方法是使用一个顶端很细的管,叫鲁金毛细管,将参比电极插入其中。参比电极的位置应是固定的,以便Ru不受影响。
虽然说"不让电流流到参比电极",但作为参比电极在电路中,每分钟都有电流流过它,所以它的阻抗必须被考虑。参比电极的阻抗的增加会导致时间常数的增加,这由工作电极界面的双电层电容和参比电极本身的阻抗决定。这意味着整个系统包括电化学电池和恒电位仪的带宽变得狭窄而且响应变慢。这些情况往往导致诸如不稳定和恒电位仪对外部噪声脆弱的严重问题。预防措施是需要避免接液部发生析出而引起参比电极阻抗的进一步增加。